Anbefalinger (Quick guide)
Der skal optages anamnese og klinisk undersøgelse, hvor der lægges vægt på oplysning om varighed og væksthastighed af lymfeknuder eller tumor, symptomer på ekstranodal involvering samt B-symptomer (vægttab, nattesved og feber). Performancestatus (ECOG) skal registreres under objektiv undersøgelse ligesom alle patologiske målelige parametre beskrives. (B)
|
Undersøgelse |
Indhold |
||
|
Hæmatopatologisk revision |
Hodgkin lymfom inddeles i to hovedgrupper – klassisk Hodgkin lymfom (cHL).og den mere sjældne nodular lymphocyte predominant Hodgkin lymfom (NLPHL)(1). De forskellige subtyper af cHL behandles ens. Diagnosen bør være stillet på repræsentativt biopsi materiale, hvor hæmatopatolog har været involveret i diagnosticeringen. Hvis ikke det er tilfældet bør hæmatopatologisk revision af præparatet foretages. Diagnosen bør fortrinsvis stilles på lymfeknude extirperet in toto. Grovnålsbiopsi forbeholdes patienter med svært tilgængelig sygdom. (A) |
||
|
Klinisk-biokemiske undersøgelser: |
Htc, MCV, MCHC, Hb, leukocytter, diff.tælling, trombocytter, retikulocytter, basisk fosfatase, bilirubin, carbamid, CRP, kreatinin, kalium, natrium, LDH, urat, calcium-ion, s-albumin, IgG, IgA, IgM, TSH, glukose, sedimentationsreaktion. (B) |
||
|
Andre |
Erytrocyttype (blodtype), HIV, CMV, evt. EBV-antistoffer, evt. EBV-PCR, hepatitis B (HbsAg, HbcAB), hepatitis C. (B) |
||
|
Billeddiagnostik |
Helkrops PET-CT scanning(2) (A). Evt. røntgenundersøgelse af thorax |
||
|
Knoglemarvsundersøgelse med aspirat og biopsi: |
Anbefales ikke, hvis der foretages stadieinddeling med PET/CT(3). (B) |
||
|
Supplerende undersøgelser |
Lungefunktionsundersøgelse med måling af diffusionskapacitet bør udføres ved mistanke om betydende lungesygdom. (B) MUGA eller Ekkokardiografi bør udføres ved mistanke om betydende hjertesygdom og/eller alder over 60 år. (B) |
||
|
Nedfrysning af sæd
|
Mænd bør forud for kemoterapi tilbydes nedfrysning af sæd. (B) |
||
|
Kryopræservering af ovarievæv: |
Yngre kvinder (<35) kan ved behandling med mere end to serier BEACOPDac eller inden evt 2. linje kemoterapi, henvises til en vurdering af om der evt. skal foretages kryopræservering af ovarievæv (B) (https://fertilitetsselskab.dk/wp-content/uploads/2024/04/Fertilitetsbevaring-22FEB2021.pdf). |
||
|
Stadieinddeling |
Foretages i henhold til Lugano klassifikationen (stadium I-IV, med suffix A eller B, afhængig af tilstedeværelsen af B-symptomer)(4). (A) Tidlige stadier inkluderer: Stadium IA, IB og IIA, samt stadium IIB uden stor mediastinal tumor eller ekstranodal sygdom. Avancerede stadier inkluderer: Stadium III og IV, samt stadium IIB med stor mediastinal tumor eller ekstranodal sygdom. |
||
|
Risikostratificering af tidlige stadier |
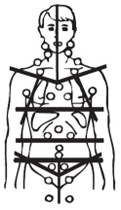
I henhold til GHSG’s definitioner: (B) a) Stor mediastinal tumor (>1/3 af thorax’ indvendige tværmål på Th5/Th6 niveau) b) Extranodal sygdom c) SR ≥ 50 uden B-symptomer eller ≥ 30 med B-symptomer d) ≥ 3 involverede områder (se figur til venstre og bilag 2) Early favourable: Stadium I-II uden risikofaktorer Early unfavourable: Stadium I eller IIA med ≥ 1 risikofaktorer, eller stadium IIB med c) eller d) men uden a) og b) |
||
|
Risikostratificering af avancerede stadier |
0 til 7 point i henhold til IPS (International Prognostic Score)(5): (B) |
||
|
Albumin Hæmoglobin Køn Stadium Alder Leukocyttal Lymfocyttal |
< 40 g/l < 6.5 mmol/l Mand IV > 45 år > 15 mia/l < 0,6 mia/l eller < 8 % af leukocytantallet |
||
|
Responsevaluering |
Hertil anvendes PET/CT i henhold til Lugano klassifikationen(4). Deauville score 1-3 opfattes som komplet metabolisk respons(2). (B) |
||
Der anbefales 2 serier ABVD konsolideret med strålebehandling 20 Gy mod de primært involverede lymfomområder. (A)
Såfremt patienten vurderes egnet til BEACOPDac, skal der laves iPET-CT efter kemoterapi men forud for ISRT. Hvis denne iPET-CT ikke er opnået komplet metabolisk remission (CMR) kan det overvejes yderligere kemoterapi i form af 2 x BEACOPDac forud for konsolidering med stråleterapi (30 Gy) mod de primært involverede lymfområder. (A)
Der anbefales:
2 serier BEACOPDac efterfulgt af 2 serier ABVD. Der skal kun gives strålebehandling INRT (eller ISRT) efter endt kemoterapi ved fortsat PET-positivitet (A)
Eller
4 serier ABVD efterfulgt af INRT (eller ISRT) mod det primært involverede lymfomvolumen til 30 Gy. (A)
Såfremt der behandles med ABVD kan patienter der er fortsat PET-positive efter de indledende 2 serier ABVD, eskaleres til 2 BEACOPDac og efterfølgende INRT (eller ISRT) jf. H10 studiet, såfremt patienten i øvrigt vurderes at kunne tåle denne intensivering (A)
Hvor der måtte være vægtige grunde imod stråleterapi, kan den konsoliderende strålebehandling hos de patienter der har en negativ interim PET/CT erstattes af yderligere 2 serier ABVD (i alt 6 serier) med kun et beskedent tab i PFS (A)
Ved alder ≥ 60 år og en ABVD-baseret strategi kan det overvejes at udelade bleomycin efter de første 2 serier ABVD for at minimere risikoen for bleomycin toksicitet. Ved alder ≥ 70 år og særligt ved pulmonal komorbiditet, kan det overvejes at udelade bleomycin fra behandlingen (AVD) (B)
Patienter med lokaliseret sygdom, dvs. involvering af én region eller to naboregioner (CS I-II) skal behandles med ISRT til 30 Gy.
Da der ikke gives systemisk behandling, er target for strålebehandlingen ikkeblot de makroskopisk involverede lymfeknuder, men også nærliggende lymfeknudeområder med betydelig risiko for mikroskopisk sygdom, baseret på en klinisk vurdering(15). (B)
Patienter med CSII NLPHL, som ikke er lokaliseret til naboregioner eller hvor > 2 regioner er involveret skal behandles med R-CHOP, R-CVP eller R-Bendamustin (B)
NLPHL er en sjælden men heterogen sygdom, som kan vise både aggressiv og mere indolent adfærd. I visse tilfælde kan en mindre intensiv strategi være relevant, herunder rituximab monoterapi eller observation uden behandling. (D)
Patienter < 60 år uden betydende komorbiditet:
Der anbefales:
2 serier BEACOPDac efterfulgt af iPET/CT. Herefter yderligere 4 serier BEACOPDac hvis iPET positiv, eller yderligere 2 serier BEACOPDac (eller alternativt yderligere 4 serier ABVD) hvis iPET negativ (A)
Eller
2 serier BRECADD efterfulgt af iPET/CT. Herefter yderligere 4 serier BRECADD hvis iPET positiv, eller yderligere 2 serier BRECADD hvis iPET negativ (A) ● ● ●
Patienter ≥ 60 år eller yngre med betydende komorbiditet:
Der anbefales:
2 serier ABVD efterfulgt af iPET/CT. Herefter yderligere 4 serier AVD hvis iPET negativ eller yderligere 4 serier BEACOPDac hvis iPET positiv (A)
Eller
6 serier N-AVD (endnu ikke godkendt af EMA eller vurderet af Medicinrådet) (A)
Eller
6 serier A-AVD (A) ● ● ●
Der gives konsoliderende strålebehandling til 30-36 Gy mod evt. restlymfom, som er PET-positiv efter endt systemisk behandling. (A)
Hos ældre patienter, hvor ABVD og A-AVD skønnes vanskeligt gennemførlig, og hvor N-AVD ikke er tilgængelig, kan mindre toksiske regimer (f.eks. AVD eller CHOP) anvendes, evt. med reduceret dosis af de enkelte cytostatika (se anbefaling 7). (B)
For behandlinger ikke vurderet eller ikke godkendt af Medicinrådet skal regionale retningslinjer for ansøgning om ibrugtagelse følges.
● ● ●Godkendt af EMA på denne indikation, men forholdet mellem omkostninger og effekt/sikkerhed er endnu ikke vurderet af Medicinrådet
Der anbefales:
6 serier R-CHOP (C)
Eller
6 serier R-CVP (C)
Eller
6 serier R-Bendamustin (C)
NLPHL er en sjælden men heterogen sygdom, som kan vise både aggressiv og mere indolent adfærd. I visse tilfælde kan en mindre intensiv strategi være relevant, herunder R-bendamustin, rituximab monoterapi eller endog observation uden behandling. (D)
Der er ingen enkel måde til at risikostratificere den enkelte patient. Dog kan man forsøge at kategorisere den enkelte patient som ”fit” eller ”unfit” på baggrund af en klinisk vurdering evt. med indragelse af almindeligt anvendte værktøjer som performance score (ECOG eller Karnofsky), CIRS-G, ADL, MMSE mfl. (C)
Forfase med prednisolon kan anvendes (60-100 mg/ dag) i ca. 5 dage for at forbedre performance status forud for behandlingsvalg (C)
Behandling af tidlige stadier kan bestå af følgende:
Fit: AVD * 2-4 + stråleterapi (primær anbefaling) eller CHOP * 3-4 + stråleterapi, VEPEMB * 3 + stråleterapi, AVD * 4-6, COPP *4 + stråleterapi (B)
Unfit: VEPE(M)B * 3 + stråleterapi, BV + Darcarbazin, Enkeltstofbehandling (e.g. BV, pembrolizumab, nivolumab, Lomustine, Etoposid, Chlorambucil eller Dexametason)ChlVPP + stråleterapi, + evt stråleterapi, stråleterapi (monoterapi), Best supportive care (B)
Behandling af avanceret sygdom kan bestå af følgende:
Fit: N-AVD x 6, AVD * 6 + evt stråleterapi v. PET-pos restlymfom (primær anbefaling), sekventiel BV/AVD eller CHOP (B)
Unfit: BV-Darcabazine, BV, ChlVPP, enkeltstofbehandling (e.g. pembrolizumab, nivolumab, BV, Bendamustin, Etoposid, Chlorambucil eller Dexametason), Best supportive care (B)
Der anbefales HDT-ASCT standard behandling ved recidiv af cHL hos yngre patienter uden væsentlig co-morbiditet. (A)
Opnåelse af metabolisk CR vurderet ved PET-CT før HDT-ASCT er afgørende for prognosen. Det er derfor standard at foretage responsvurdering med PET-CT før HDT-ASCT. Hvis det ikke er muligt at opnå CR på første afprøvede reinduktions regime, kan forsøges med alternativt reinduktions regime, evt. med tillæg af Brentuximab Vedotin (BV) eller kombination af BV og PD1-hæmmer.
Strålebehandling kan overvejes ved beskeden sygdomsbyrde og/eller refraktær sygdom enten før eller efter HDT-ASCT. (B)
BV konsolidering efter HDT-ASCT bør overvejes og vurderes at være standard behandling ved tilstedeværelse af risikofaktorer (primær refraktær sygdom, hurtigt recidiv (< 1 år), samt ekstranodal sygdom ved recidiv efter 1. linje behandling). (A)
Ved mistanke om recidiv af NLPHL skal der altid tages biopsi, da transformering til aggressivt B-celle lymfom ikke er sjældent (B)
Lokaliseret recidiv kan behandles med strålebehandling (C)
Recidiv efter strålebehandling alene kan behandles med konventionel kemoterapi, f.eks. ABVD, CHOP eller Bendamustin, ofte i kombination med Rituximab, evt. kombineret med strålebehandling. (C)
Recidiv efter tidligere systemisk behandling kan behandles som ved klassisk Hodgkin lymfom. Sygdommen har undertiden et meget indolent forløb, og hvis der ikke er symptomer der kræver behandling, kan man vente og observere eller evt. give Rituximab som enkeltstof. (C)
Pembrolizumab anbefales til behandling af relaps/refraktær sygdom hos patienter der har gennemgået højdosis kemoterapi med autolog stamcelletransplantation (A)
For patienter der ikke tidligere har modtaget behandling med brentuximab vedotin og hvor pembrolizumab enten ikke er en mulighed eller ved relaps/progression efter denne anbefales brentuximab vedotin (B)
Nivolumab anbefales til patienter med relaps/refraktær sygdom efter højdosis kemoterapi med autolog stamcelletransplantation og behandling med brentuximab vedotin (B)
Hos patienter med avanceret sygdom der opnår fornyet remission efter PD-1 hæmmer eller brentuximab vedotin kan der, i udvalgte tilfælde, overvejes konsoliderende RIC allogen knoglemarvstransplantation (C)
Der bør undersøges for mulighed for deltagelse i protokolleret behandlingsforsøg (A)
Bendamustin monoterapi kan overvejes (B)
Hos patienter med lokaliseret sygdom der opnår fornyet remission efter brentuximab eller PD-1 hæmmer bør stråleterapi i ikke-tidligere strålebehandlede (evt. også i tidligere strålebehandlede) områder overvejes (C)
Mulighed for deltagelse i protokollerede forsøg skal undersøges (A)
For patienter med lokaliseret recidiv uden for tidligere strålefelter kan radioterapi overvejes (C)
Behandling med PD-1 hæmmer kan overvejes (C)
Behandling med brentuximab vedotin kan overvejes (C)
Donor lymfocyt infusion kan overvejes (C)
Der anbefales pembrolizumab (A)
For patienter der har modtaget mindst to tidligere behandlingslinjer og hvor flerstofs kemoterapi ikke er en mulighed anbefales brentuximab vedotin (B)
Hos ældre patienter kan gemcitabin eller bendamustin monoterapi overvejes (B)
Der bør undersøges for mulighed for deltagelse i protokolleret forsøg (A)
Stråleterapi kan anvendes ved lokaliserede recidiver (B), samt som palliativ behandling mod symptomgivende områder eller mod områder, hvor der er risiko for kompromittering af organfunktion (C)
|
Scanning efter afsluttet behandling |
Ved evaluering af behandlingsrespons anbefales PET/CT cirka 4 til 8 uger efter afsluttet kemoterapi eller cirka 10-12 uger efter afsluttet strålebehandling (B)
Der anbefales ingen opfølgende rutineskanninger til patienter, som har opnået CR (C)
Fremmøder kan erstattet af PRO/telefon kontakt på individuel vurdering (D) |
|
cHL:
|
Patienter med cHL i CR følges, afhængigt af individuelt skøn, med klinisk kontrol inkl. blodprøver 2-4 gange årligt det første år og herefter hver 6. måned i det andet år. efter 1. linjebehandling. Efter relapsbehandling følges patienterne i 4-5 år (C) |
|
NLPHL:
|
Patienter med NLPHL i CR følges, afhængigt af individuelt skøn, med klinisk kontrol inkl. blodprøver 2-4 gange årligt i de 2 år efter 1. linjebehandling og herefter 1-2 gange årligt i 5-10 år (C) |
4. oktober 2025
De sygdomsspecifikke retningslinjer bør beskrive et standard post-terapeutisk opfølgningsforløb for patienter med lymfom/CLL. Retningslinjer bør også beskrive et opfølgningsforløb for patienter observeret uden tidligere behandling (watch and wait).
De sygdomsspecifikke retningslinjer beskriver, hvor hyppigt patienterne som udgangspunkt bør ses på forskellige tidspunkter i deres sygdomsforløb. Udgangspunktet har tidligere været kliniske kontroller med fremmøde og blodprøver. Det er dog vigtigt at anføre, at der er tale om konsensusbaserede opfølgningsforløb. Der er således ikke tung evidens for, hvordan et opfølgningsforløb for lymfom/CLL bør tilrettelægges.
I de senere år har der været øget fokus på anvendelse af PRO og behovsstyrede kontrolforløb. Der er også efter COVID et øget brug af telefonkontroller og virtuelle kontakter i sundhedsvæsenet.
Dette dokument er et tillæg til vores kliniske retningslinjer. Dokumentet er godkendt af alle bestående retningslinjegrupper i regi af DLG. Det er udarbejdet for at sikre, at kontrolforløbene for lymfom/CLL er fleksible og inkluderer alternativer til kontroller med fremmøde.
Den behandlende læge kan i samråd med patienten kan tilrettelægge individualiserede opfølgningsforløb for lymfom/CLL, hvori der f.eks. kan indgå:
•Telefonkontroller
•Videokonsultationer
•PRO-skemaer
•Åbne forløb med mulighed for selvhenvendelse (lav-maligne lymfomer/CLL)
Disse elementer kan erstatte f.eks. (eller evt. dele af) fremmødekontrollerne. Det er vigtigt, at de individualiserede forløb tager udgangspunkt i patientens situation, herunder særligt egenomsorg og sygdomsindsigt. Det er således mere oplagt at inddrage virtuelle/elektroniske elementer i opfølgningsforløbet til patienter med god egenomsorg og som har en tilstrækkelig sygdomsindsigt, herunder forståelse for, hvornår man bør kontakte afdelingen. Dette er en vurdering, der bør foretages af klinikere med kendskab til patienten og kræver periodisk revurdering af om forudsætningerne fortsat er givet. Åbne forløb uden fastsatte aftaler kan være en mulighed ved lavmaligne lymfomer hos patienter, der efter nogle år med faste kontroller fortsat ikke har tegn på sygdomsaktivitet.
Dette dokument er et tillæg til retningslinjerne for:
- CLL
- Diffust storcellet B-celle lymfom
- Perifere T-celle lymfomer
- Follikulært lymfom
- Marginalzone lymfomer
- CNS lymfom
- Mantlecelle lymfom
- Lymfoplasmacytært lymfom/Mb Waldenstrøm
- Aggressive B-celle lymfomer
- Sjældne lymfoide leukæmier i hæmatologien
- Hodgkin lymfom
Version 2.0
GODKENDT
Faglig godkendelse
5. december 2025 (DLG)
Administrativ godkendelse
7. januar 2026 (Retningslinjefunktionen i Sundhedsvæsenets Kvalitetsinstitut)
REVISION
7. januar 2026 (Retningslinjefunktionen i Sundhedsvæsenets Kvalitetsinstitut)